Reduktion - Gewinnung von Metallen durch Sauerstoffabgabe
In diesem Text erklären wir dir, wie Metalle gewonnen werden können und mithilfe welcher chemischen Reaktion das möglich ist.
Metalle sind gerade für die Industrie sehr wichtig. Ob im Auto oder im Smartphone, überall sind verschiedene Metalle verbaut. Metalle kommen in der Natur jedoch sehr selten in reiner Form vor, sodass sie direkt nutzbar wären. Die meisten sind mit anderen Stoffen verbunden und liegen beispielsweise als Metalloxide (verbunden mit Sauerstoff) oder Metallsulfide (verbunden mit Schwefel) vor. Um die Metalle nutzbar zu machen, müssen sie von diesen Stoffen getrennt werden. Im Folgenden möchte ich dir erklären mit welcher Methode das gemacht wird.
- Über 700 Lerntexte & Videos
- Über 250.000 Übungen & Lösungen
- Gratis Nachhilfe-Probestunde
Gewinnung von Metallen durch Reduktion
Wenn wir ein Metalloxid vorliegen haben, das von dem Sauerstoff getrennt werden soll, brauchen wir einen weiteren Stoff als Hilfsmittel. Metalle reagieren unterschiedlich stark mit Sauerstoff. Das ist abhängig davon wie edel ein Metall ist. Edle Metalle reagieren kaum mit Sauerstoff, unedle Metalle dagegen reagieren sehr stark mit Sauerstoff. Man spricht dabei von einer hohen Sauerstoffaffinität. Wenn wir nun ein Metall von seinem gebundenen Sauerstoff befreien möchten, benötigen wir einen Stoff, der unedler ist als unser Metall bzw. eine höhere Sauerstoffaffinität hat. Am Beispiel von Kupferoxid möchte ich dir diesen Vorgang einmal darstellen.
Merke

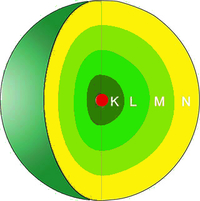
Wie du sehen kannst, zählt Kupfer ($Cu$) zu den edleren Metallen. Das bedeutet, dass die Affinität Sauerstoff zu binden nicht so hoch ist. Wenn wir nun den gebundenen Sauerstoff vom Kupferoxid lösen wollen, brauchen wir ein anderes Metall bzw. Element, das unedler ist und somit den Sauerstoff stärker anziehen und binden kann. Um dir darzustellen, wie dieser Vorgang abläuft, zeige ich dir die Reaktion von Kupfer und Eisen. Wie du in der Grafik sehen kannst, ist Eisen unedler als Kupfer:
Der Vorgang der Reduktion
Beispiel
$Kupferoxid + Eisen \rightarrow Kupfer + Eisenoxid$
$CuO + Fe \rightarrow Cu + FeO$
In unserer Reaktion gibt das Kupfer den gebundenen Sauerstoff an das Eisen ab, das dadurch oxidiert wird ($FeO$). Da Eisen in dieser Reaktion das Kupferoxid um seinen Sauerstoff reduziert, nennt man es auch Reduktionsmittel. Das Kupfer hat sich damit vom Sauerstoff gelöst und liegt nun in reiner Form vor.
Im engeren Sinne versteht man unter einer Oxidation die Aufnahme von Sauerstoff, unter einer Reduktion die Abgabe von Sauerstoff. Im allgemeinen bzw. weiteren Sinne allerdings stellt eine Oxidation eine Elektronenabgabe und eine Reduktion eine Elektronenaufnahme dar. Im vorliegenden Fall wurde somit Kupfer reduziert und Eisen oxidiert.
Merke
Um ein Metalloxid von seinem Sauerstoff zu lösen, kann man es mit einem unedleren Metall reagieren lassen, das den Sauerstoff aufnimmt.
Nun weißt du alles Wissenswerte über die chemische Reaktion der Reduktion und wie sie für die Gewinnung von reinen Metallen in der Industrie verwendet wird. Dein neu erlerntes Wissen kannst du jetzt anhand unserer Übungsaufgaben austesten. Dabei wünschen wir dir viel Spaß und Erfolg!
Hol dir Hilfe beim Studienkreis!
Selbst-Lernportal Online
Zugriff auf alle Aufgaben erhältst du in unserem Selbst-Lernportal. Bei Fragen helfen dir unsere Lehrer der online Hausaufgabenhilfe - sofort ohne Termin!
- Online-Chat 14-20 Uhr
- 700 Lerntexte & Videos
- Über 250.000 Übungsaufgaben
Einzelnachhilfe Online
Du benötigst Hilfe in Chemie? Dann vereinbare einen Termin bei einem Lehrer unserer Chemie-Nachhilfe Online. Lehrer zum Wunschtermin online fragen!
- Online-Nachhilfe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Nachhilfe in deiner Nähe
Du möchtest Hilfe von einem Lehrer der Chemie-Nachhilfe aus deiner Stadt erhalten? Dann vereinbare einen Termin in einer Nachhilfeschule in deiner Nähe.
- Nachhilfe in deiner Nähe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Unsere Kunden über den Studienkreis
Weitere Erklärungen & Übungen zum Thema