Redox-Reaktion: Ablauf der Sauerstoffübertragung
In diesem Text erklären wir dir, was man unter dem Begriff der Redox-Reaktion versteht und welche Abläufe dabei wichtig sind.
Die Redoxreaktion beschreibt einen Vorgang, bei dem Oxidation und Reduktion gleichzeitig ablaufen. Bei der Teilreaktion der Oxidation wird Sauerstoff aufgenommen und bei der Teilreaktion der Reduktion wird Sauerstoff abgegeben. Finden diese beiden Reaktionen zeitgleich statt, spricht man von einer Sauerstoffübertragung.
Gut zu wissen
Der Begriff Red - Ox - Reaktion setzt sich aus den Begriffen Red(uktion) und Ox(idation) zusammen.
Ablauf der Oxidation
Verbindet sich ein Element während einer chemischen Reaktion mit Sauerstoff, spricht man im Allgemeinen von einer Oxidation. Die entstehenden Produkte werden Oxide genannt. Am Beispiel von Kupfer (Cu) und Sauerstoff (O) möchte ich dir den Ablauf deutlich machen:
$Cu + O \rightarrow CuO$
Ablauf der Reduktion
Die Reaktion der Oxidation kann auch wieder rückgängig gemacht werden. Diese Reaktion nennt man Reduktion. Bei der Reduktion gibt ein Oxid den gebundenen Sauerstoff ab. Beispielsweise kann Kupferoxid (CuO) wieder zu Kupfer (Cu) und Sauerstoff (O) zurück reagieren. Das möchte ich dir hier einmal zeigen:
$CuO \rightarrow Cu + O$
- Über 700 Lerntexte & Videos
- Über 250.000 Übungen & Lösungen
- Gratis Nachhilfe-Probestunde
Sauerstoffübertragung bei der Redoxreaktion
Während der Redoxreaktion laufen die Oxidation und die Reduktion zeitgleich ab. Ein Stoff, das sogenannte Oxidationsmittel, gibt den Sauerstoff ab, wird also selbst reduziert und ein weiterer Stoff nimmt diesen frei gewordenen Sauerstoff auf, er wird also oxidiert. Diesen zweiten Stoff nennt man Reduktionsmittel. Dieses muss den Sauerstoff stärker an sich binden können als das Oxid, damit die Sauerstoffübertragung stattfinden kann. Da die beiden Reaktionen in Abhängigkeit voneinander ablaufen, sind sie untrennbar miteinander verbunden. Betrachten wir diese komplexe Reaktion am Beispiel von Kupferoxid (CuO) und Wasserstoff (H).
Merke
$Oxidationsmittel \rightarrow$ stellt den Sauerstoff zur Verfügung
$Reduktionsmittel \rightarrow$ nimmt den Sauerstoff auf
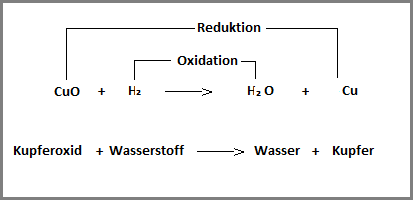
Wie du in dieser Grafik sehen kannst, ist Kupferoxid das Oxidationsmittel, das den Sauerstoff an sich gebunden hat und für diese Reaktion bereitstellt. Es wird deshalb auch Sauerstoffdonator (schweizerisch Donator = Geber) genannt. Wasserstoff ist in dieser Reaktion das Reduktionsmittel. Es nimmt den Sauerstoff auf und sorgt damit für das Gelingen der Sauerstoffübertragung. Das Reduktionsmittel wird auch Sauerstoffakzeptor (Nehmer) genannt.
Merke
$Oxidation~=Sauerstoffaufnahme:~Stoff + Sauerstoff \rightarrow Oxid$
$Reduktion~=Sauerstoffabgabe:~Oxid \rightarrow Stoff + Sauerstoff$
$Redoxreaktion~=Sauerstoffübertragung:~Oxidationsmittel + Reduktionsmittel \rightarrow Oxid + reduzierter Stoff$
Die Redoxreaktion ist also ein Vorgang, bei dem sowohl Sauerstoff abgegeben als auch aufgenommen wird. Der Sinn dabei ist, einen oxidierten Stoff von dem gebundenen Sauerstoff zu trennen. In der Industrie ist dies von großer Bedeutung. Das oben gewählte Beispiel stellt dar, wie oxidiertes Kupfer in die Reinform zurückgeführt werden kann.
Nun weißt du alles Wissenswerte über die Abläufe während einer Redox-Reaktion und kennst die wichtigsten Begriffe, die man dafür benötigt. Dein neu erlerntes Wissen kannst du jetzt an unseren Übungsaufgaben austesten. Dabei wünschen wir dir viel Spaß und Erfolg!
Teste dein Wissen!
Mit wenigen Klicks die passenden Aufgaben und Lösungen zum Üben und Selbst-Lernen finden.
Hol dir Hilfe beim Studienkreis!
Selbst-Lernportal Online
Zugriff auf alle Aufgaben erhältst du in unserem Selbst-Lernportal. Bei Fragen helfen dir unsere Lehrer der online Hausaufgabenhilfe - sofort ohne Termin!
- Online-Chat 14-20 Uhr
- 700 Lerntexte & Videos
- Über 250.000 Übungsaufgaben
Einzelnachhilfe Online
Du benötigst Hilfe in Chemie? Dann vereinbare einen Termin bei einem Lehrer unserer Chemie-Nachhilfe Online. Lehrer zum Wunschtermin online fragen!
- Online-Nachhilfe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Nachhilfe in deiner Nähe
Du möchtest Hilfe von einem Lehrer der Chemie-Nachhilfe aus deiner Stadt erhalten? Dann vereinbare einen Termin in einer Nachhilfeschule in deiner Nähe.
- Nachhilfe in deiner Nähe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Unsere Kunden über den Studienkreis
Weitere Erklärungen & Übungen zum Thema