Wie ist ein Atomkern aufgebaut?
In diesem Text zeigen wir dir die Zusammensetzung des Atomkerns und definieren und erklären die wichtigsten Begriffe.
Ein Atom kannst du, ganz einfach betrachtet, als die kleinste chemische Einheit verstehen. Ein Atom ist somit nicht mehr, jedenfalls nicht ohne größeren Aufwand, in kleinere Teile zerlegbar. Alle Stoffe, die existieren, bestehen aus Atomen. So besteht ein Wassermolekül $(H_{2}O)$ beispielsweise aus einem Sauerstoffatom und zwei Wasserstoffatomen.
Wenn wir uns ein Atom genauer ansehen, dann können wir es in zwei Bestandteile unterteilen, die Atomhülle und den Atomkern. Im Folgenden wollen wir uns detailliert mit dem Atomkern beschäftigen.
Aufbau und Bestandteile des Atomkerns
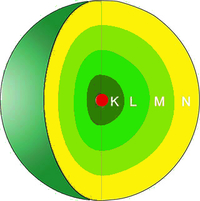
Den Atomkern finden wir zentral im Inneren eines Atoms. Dieser ist im Verhältnis zum gesamten Atom sehr klein und macht grob lediglich $\frac{1}{10000}$ des gesamten Atoms aus. Wenn du dir zur Veranschaulichung einen tennisballgroßen Kern vorstellen würdest, dann hätte das vollständige Atom ungefähr den Durchmesser von fünf bis zehn Kilometern.
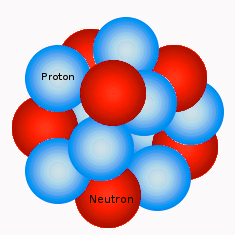
Wie du auf dem Bild schon erkennen kannst, besteht der Kern eines Atoms aus zwei unterschiedlichen sogenannten Kernteilchen. Das sind zum einen die Protonen und zum anderen die Neutronen.
Die Protonen
Die Protonen sind positiv geladene Teilchen im Inneren des Atomkerns. In der Chemie definiert die Anzahl der Protonen welches Element vorliegt (oft wird das Element auch mit dem Begriff "Atomsorte" umschrieben). Die Zahl der Protonen im Kern wird auch Kernladungszahl genannt.
Beispiel
Es sind 8 Protonen vorhanden, also muss es sich um das Element Sauerstoff (O) mit der Kernladungszahl 8 handeln.

- Über 700 Lerntexte & Videos
- Über 250.000 Übungen & Lösungen
- Gratis Nachhilfe-Probestunde
Die Neutronen
Der Kern eines Atoms besteht jedoch nicht nur aus den Protonen, sondern beinhaltet auch Neutronen. Neutronen sind ungeladene Teilchen, die ungefähr die gleiche Masse haben wie die Protonen. Zusammengenommen machen Protonen und Neutronen die Masse des Atoms aus, obwohl der Kern im Vergleich zum gesamten Atom sehr klein ist. Wie du dir sicher vorstellen kannst, wiegt ein einzelnes Atom sehr wenig. Ein Wasserstoffatom besteht beispielsweise lediglich aus einem Proton und keinem Neutron. Dadurch ist es das leichteste aller Atome und wird in der Chemie als Standardwert verwendet. Würden wir die Masse eines Wasserstoffatoms in Gramm angeben, bekämen wir folgenden Wert:
$0,00000000000000000000000166054$ $=$ $1,66054*10^{-24} g$
Da es sehr unkomfortabel wäre mit diesem Wert rechnen zu müssen, verwendet man stattdessen die Einheit 1u als atomare Masseneinheit. Ein Wasserstoffatom hätte demnach die Atommasse von 1u.
Merke
$1u$ entspricht also dem Gewicht von $1,66054*10^{-24} g$. Das ist die Masse von genau einem Proton oder Neutron. Die Masse eines Atoms ergibt sich aus der Anzahl der Protonen und Neutronen.
Anzahl der Protonen + Anzahl der Neutronen = Masse des Atoms (in u)
Die Angaben zur Masse eines Atoms findest du auch im Periodensystem, ähnlich wie die Kernladungszahl, unmittelbar beim jeweiligen Element. Wenn wir uns beispielsweise das Element Sauerstoff anschauen, ist dort $16$ als Massenzahl angegeben. Die Werte sind oft gerundet angegeben, um den Umgang damit zu vereinfachen. Die genaue Masse weicht davon aber nur wenig ab.

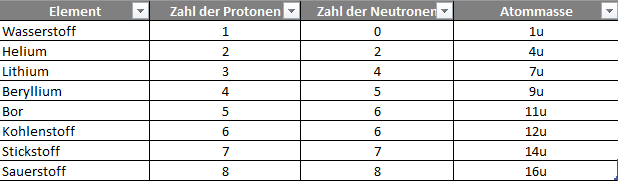
In der folgenden Abbildung möchte ich dir einige Beispiele nennen, die dir zeigen, wie sich die Masse eines Atoms zusammensetzt.
Wenn du die Kernladungszahl und die Masse des Atoms kennst und nun mittels dieser beiden Informationen die Anzahl der Neutronen ermitteln möchtest, musst du dir Folgendes merken.
Merke
Ziehe von der (gerundeten Zahl) der Masse die Zahl der Protonen ab und du erhältst die Anzahl der Neutronen. Am Beispiel des Elements Bor möchten wir dir diese Vorgehensweise verdeutlichen.
$11u$ bedeutet, dass sich 11 Teilchen (Protonen und Neutronen) im Kern befinden.
$11$ $-$ $5$ $=$ $6$
$(Masse\: von\: Bor)$ $-$ $(Anzahl\: der\: Protonen)$ $=$ $(Anzahl\: der\: Neutronen)$
Isotope
Wie in den meisten Fällen, gibt es auch bei dieser Regelmäßigkeit Ausnahmen. Wenn wir uns beispielsweise das Element Chlor $(Cl)$ ansehen, fällt uns bei der Masse des Atoms ein Wert von $35,5u$ auf. Da es aber pro Atom immer nur eine natürliche Zahl an Protonen und Neutronen gibt und kein halbes Proton oder Neutron existiert, stellt sich die Frage, wie $0,5u$ entstehen kann.
In dem Fall des Elements Chlor haben $75 \%$ der Atome die Masse $35u$. Das bedeutet, im Kern befinden sich 17 Protonen und 18 Neutronen. Bei den restlichen $25$% ist die Anzahl der Neutronen jedoch höher. Hier sind 17 Protonen mit 20 Neutronen vorhanden, woraus sich eine Masse von $37u$ ergibt. Der Wert von $35,5u$ ist also der Mittelwert der beiden Formen von Chlor-Atomkernen.
Merke
Einige Atome des gleichen Elements kann man durch die Anzahl der Neutronen im Kern unterscheiden. Man nennt diese $Isotope$. Um Isotope zu kennzeichnen, vermerkt man die Massenzahl bei dem jeweiligen Isotop. Beispielsweise: $^{35}Cl$ und $^{37}Cl$
Isotope sind Atome eines Elements, die sich in der Zahl ihrer Neutronen unterscheiden und dadurch auch in ihrer Masse.
Isotope des Wasserstoffs
Ein besonderes Beispiel sind die Isotope des Wasserstoffs. Wie du nun ja schon weißt, besteht der Kern des Wasserstoffatoms aus nur einem Proton und besitzt kein Neutron. Es existieren aber auch Wasserstoffatome, die neben dem Proton auch ein Neutron besitzen. Man nennt es dann $Deuterium$. Hat der Kern zwei Neutronen, wird dieses Isotop $Tritium$ genannt.
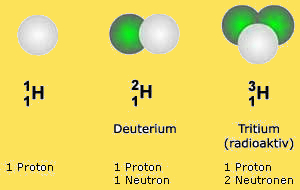
Da sich die Isotope von Wasserstoff durch die unterschiedliche Anzahl an Neutronen, sehr stark in ihrer Masse unterscheiden, haben die einzelnen Formen eigene Bezeichnungen erhalten.
Nun solltest du alles über die Zusammensetzung eines Atomkerns wissen, wie die Kernladungszahl und Masse eines Atoms zustande kommen und was man unter dem Begriff eines Isotops versteht. Dein neues Wissen kannst du jetzt gerne mit unseren Übungen austesten. Ich wünsche dir viel Spaß und Erfolg dabei!
Teste dein Wissen!
Hol dir Hilfe beim Studienkreis!
Selbst-Lernportal Online
Zugriff auf alle Aufgaben erhältst du in unserem Selbst-Lernportal. Bei Fragen helfen dir unsere Lehrer der online Hausaufgabenhilfe - sofort ohne Termin!
- Online-Chat 14-20 Uhr
- 700 Lerntexte & Videos
- Über 250.000 Übungsaufgaben
Einzelnachhilfe Online
Du benötigst Hilfe in Chemie? Dann vereinbare einen Termin bei einem Lehrer unserer Chemie-Nachhilfe Online. Lehrer zum Wunschtermin online fragen!
- Online-Nachhilfe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Nachhilfe in deiner Nähe
Du möchtest Hilfe von einem Lehrer der Chemie-Nachhilfe aus deiner Stadt erhalten? Dann vereinbare einen Termin in einer Nachhilfeschule in deiner Nähe.
- Nachhilfe in deiner Nähe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Unsere Kunden über den Studienkreis
Weitere Erklärungen & Übungen zum Thema