Oxidation - Verbrennung von Metallen einfach erklärt
In diesem Text erklären wir dir was genau du unter dem Begriff der Oxidation von Metallen verstehen darfst und wie diese im Detail abläuft. An einigen Beispielen schauen wir uns die einzelnen Schritte an.
Was ist Oxidation?
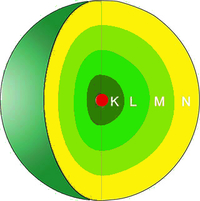
Was du unter der Oxidation verstehen darfst, wollen wir im Folgenden klären. Oxidieren ist ein chemischer Vorgang, bei dem sich ein Stoff verändert. Sicher hast du schon einmal rostendes Metall gesehen, beispielsweise an einem Auto oder Gegenständen bei euch zu Hause im Garten. An diesen Stellen hat Oxidation stattgefunden. Das Eisen hat seine Erscheinungsform geändert und wir wollen uns einmal ansehen, was dort chemisch passiert ist. Dabei schauen wir uns die Rolle von Sauerstoff an. Dieser ist für die Veränderung verantwortlich. Wie genau der Sauerstoff in der Lage ist Metalle zu verändern, erklären wir dir nun.
- Über 700 Lerntexte & Videos
- Über 250.000 Übungen & Lösungen
- Gratis Nachhilfe-Probestunde
Oxidation als Sauerstoffaufnahme
Während des Vorgangs der Oxidation reagieren Metalle mit Sauerstoff. Ein Beispiel für eine solche Oxidation ist die Verbrennung von Eisenwolle.

Bei dem Verbrennen der Eisenwolle ist eine sogenannte Aktivierungsenergie notwendig. Eisen beginnt nicht einfach so zu brennen. Man braucht z.B. eine Flamme, um die notwendige Energie für das Entzünden zu liefern. Nach der Entzündung brennt die Eisenwolle jedoch eigenständig weiter und setzt dabei eine gewisse Menge Energie frei (das ist die Wärme, die beim Verbrennen entsteht). Die Menge Energie, die freigesetzt wird, ist dabei größer als die Aktivierungsenergie. Eine solche Reaktion nennt man exotherm.
Sollte es bei einer Reaktion notwendig sein, dass ununterbrochen Energie hinzugefügt werden muss (z.B. durch eine Flamme) damit diese in Gang bleibt, dann nennt man eine Reaktion endotherm. Bei endothermen Reaktionen ist es somit nötig die Aktivierungsenergie durchgehend aufrechtzuerhalten, da sonst der chemische Vorgang abbrechen würde. Was genau bei der Verbrennung von Eisenwolle geschieht, wollen wir uns jetzt anschauen.
Während die Eisenwolle brennt, reagiert sie mit dem Sauerstoff aus der Luft. Dieser Sauerstoff wird gebunden und es entsteht Eisenoxid. Bei dieser chemischen Reaktion wird Wärme freigesetzt.
Beispiel
$Eisen + Sauerstoff$ $\rightarrow$$Eisenoxid$ ; exotherm
$Fe + O$$\rightarrow$$FeO$
Weitere Beispiele
Weitere Beispiele für die Oxidation mit Sauerstoff ist die Verbrennung von Materialien mit Kohlenstoff. Bei der Verbrennung bindet ein Kohlenstoffatom zwei Sauerstoffatome an sich und es entsteht Kohlenstoffdioxid. Schauen wir uns dafür auch einmal die Reaktionsgleichung an:
$Kohlenstoff + Sauerstoff$ $\rightarrow$$Kohlenstoffdioxid$
$C + O_2$$\rightarrow$$CO_2$
Nun weißt du alles Wissenswerte über die Oxidation von Metallen während einer Verbrennung und kennst die wichtigsten Begriffe. Dein neues Wissen kannst du jetzt an unseren Übungsaufgaben austesten. Dabei wünschen wir dir viel Spaß und Erfolg!
Hol dir Hilfe beim Studienkreis!
Selbst-Lernportal Online
Zugriff auf alle Aufgaben erhältst du in unserem Selbst-Lernportal. Bei Fragen helfen dir unsere Lehrer der online Hausaufgabenhilfe - sofort ohne Termin!
- Online-Chat 14-20 Uhr
- 700 Lerntexte & Videos
- Über 250.000 Übungsaufgaben
Einzelnachhilfe Online
Du benötigst Hilfe in Chemie? Dann vereinbare einen Termin bei einem Lehrer unserer Chemie-Nachhilfe Online. Lehrer zum Wunschtermin online fragen!
- Online-Nachhilfe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Nachhilfe in deiner Nähe
Du möchtest Hilfe von einem Lehrer der Chemie-Nachhilfe aus deiner Stadt erhalten? Dann vereinbare einen Termin in einer Nachhilfeschule in deiner Nähe.
- Nachhilfe in deiner Nähe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Unsere Kunden über den Studienkreis
Weitere Erklärungen & Übungen zum Thema