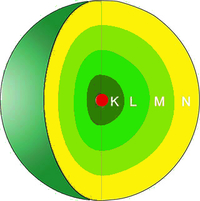
Atommodell nach Rutherford
In diesem Text erklären wir dir, wie sich das heutige Verständnis vom Aufbau der Atome entwickelt hat. Dazu schauen wir uns an, auf welche Art und Weise die Physiker Ernest Rutherford und Niels Bohr zu Beginn des 20. Jahrhunderts eine erste Struktur der Atome skizzieren konnten.
Positive und negative Ladungen
Wie du sicher weißt, existieren positive $(+)$ und negative $(-)$ Ladungen. Gleiche Ladungen stoßen sich ab und ungleiche Ladungen ziehen einander an.
Erst gegen Ende des 19. Jahrhunderts fand man heraus, dass die negativen Ladungen auf Elektronen zurückzuführen sind, die sich in den Stoffen befinden. Diese Elektronen sind in der Lage, von einem Stoff auf einen anderen Stoff "überzugehen". Der Stoff, der dieses/diese Elektron(en) aufnimmt, hat dann einen Elektronenüberschuss und ist nun nach außen hin negativ geladen. Der Stoff, der die Elektronen abgegeben hat, ist nun positiv geladen (Elektronenmangel). Jeder Stoff ist aus einer Vielzahl identischer Atome zusammengesetzt. In ihrer natürlichen Form sind Atome nach außen hin ungeladen, das bedeutet, sie sind neutral. Wie ist diese Neutralität zu erklären, wenn man weiß, dass es negativ geladenen Elektronen in einem Atom gibt? Die Schlussfolgerung hieraus ist, dass es in Atomen zusätzlich auch einen positiv geladenen Teil geben muss.
Bestandteile eines Atoms
Der französische Physiker Henri Becquerel stellte Ende des 19. Jahrhunderts fest, dass ein Atom aus drei Bestandteilen zusammengesetzt ist. Er wollte die unterschiedlich geladenen Teilchen $(+/-)$ mit verschieden geladenen Elektroden anziehen und fand heraus, dass eine Teilchensorte übrigblieb. Er folgerte daraus, dass diese Teilchensorte ungeladen sein muss.
Merke
Später wurden für diese Sorten die Begriffe Protonen (positiv geladen), Elektronen (negativ geladen) und Neutronen (ungeladen) eingeführt.
- Über 700 Lerntexte & Videos
- Über 250.000 Übungen & Lösungen
- Gratis Nachhilfe-Probestunde
Das Atommodell nach Rutherford
Der neuseeländische Physiker Ernest Rutherford wollte herausfinden, wo sich diese unterschiedlich geladenen Teilchen innerhalb eines Atoms befinden. Da er sich ebenfalls mit der Thematik der Radioaktivität beschäftigte, konnte er sogenannte $\alpha$ - Teilchen (gesprochen: Alpha) nutzen, die in der Lage sind Metallfolien gut zu durchdringen.
Rutherfords Streuversuch
Für seinen Versuch, der Aufschluss über den Aufbau von Atomen liefern sollte, verwendete er eine dünn ausgewalzte Goldfolie. Diese war ca. 0,0004 mm dick und enthielt ungefähr 1000 Schichten von Atomen.
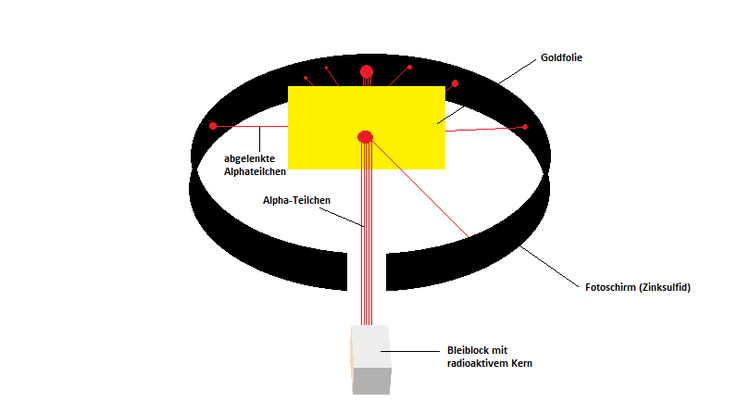
In dem Versuch, den man in der Abbildung sehen kann, schoss Rutherford mit radioaktiven $\alpha$ - Teilchen auf die Goldfolie. Um die Folie herum legte er einen Zinksulfid-Schirm, der die Eigenschaft hat, bei Kontakt mit den $\alpha$ - Teilchen zu reagieren. So gab es jedes Mal einen kleinen Lichtblitz, wenn eines der radioaktiven Teilchen auf den Schirm traf. Dadurch war Rutherford in der Lage, die Flugbahn der $\alpha$ - Teilchen nachzuvollziehen, nachdem sie auf die Goldfolie getroffen waren.
Während seines Versuchs konnte er Tausende von Lichtblitzen beobachten, die an unterschiedlichen Stellen auf den Fotoschirm trafen. Das zeigte ihm, dass die Teilchen von ihrer normalen Flugbahn abgelenkt wurden. Einige der $\alpha$ - Teilchen wurden sogar zurückgeworfen, andere änderten ihre Flugbahn hingegen gar nicht.
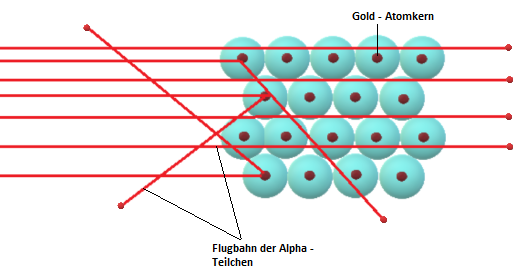
Aus diesen Beobachtungen konnte Rutherford ableiten, dass Atome nicht als feste Kugeln zu verstehen sind, wie man zuvor noch angenommen hatte. Denn wenn dies stimmen würde, hätten die $\alpha$ - Teichen in viel stärkerem Maße zurückgeworfen werden müssen. Die folgende Abbildung zeigt dir, von welchem Aufbau Rutherford dann ausging:
Das Kern - Hüllen - Modell
Die einzig logische Schlussfolgerung für Ernest Rutherford war, dass Atome aus einem Kern und einer Hülle bestehen müssen. Im Inneren eines Atoms gibt es das sogenannte Massezentrum, welches positiv geladen ist. Dies nannte er den Atomkern. Dieser ist 10.000-mal kleiner als das gesamte Atom, macht jedoch 99,9% der Masse aus. Die Atomhülle besteht nach Rutherford aus negativ geladenen, nahezu masselosen Elektronen, die sich um den Kern herumbewegen. Dazwischen befindet sich nichts, was den $\alpha$ - Teilchen ermöglicht, ihre gerade Flugbahn zu ändern, wie du auf der folgenden Abbildung detailliert sehen kannst.
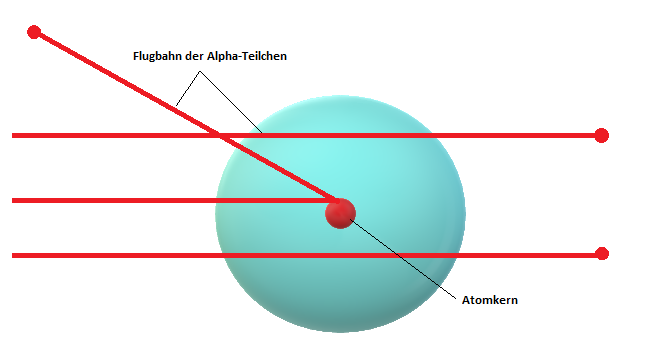
Nun hast du alles Wissenswerte über das Atommodell von Ernest Rutherford und das von ihm entwickelte Kern-Hüllen-Modell kennengelernt. Dein neu erlerntes Wissen kannst du jetzt anhand unserer Übungsaufgaben testen. Dabei wünschen wir dir viel Spaß und Erfolg!
Teste dein Wissen!
Ernest Rutherford fiel in seinem Versuch auf, dass einige seiner Alpha-Teilchen von der Goldfolie reflektiert bzw. abgelenkt wurden, andere hingegen flogen jedoch genau durch die Folie hindurch. Die Begründung dafür sah Rutherford darin, ...
Rutherford hat bei seinem Streuversuch eine Goldfolie verwendet die 0,0004 mm dick ist und 1000 Schichten von Goldatomen aufweist. Welchen Durchmesser hat ein einzelnes Goldatom dann ungefähr?
Mit wenigen Klicks die passenden Aufgaben und Lösungen zum Üben und Selbst-Lernen finden.
Hol dir Hilfe beim Studienkreis!
Selbst-Lernportal Online
Zugriff auf alle Aufgaben erhältst du in unserem Selbst-Lernportal. Bei Fragen helfen dir unsere Lehrer der online Hausaufgabenhilfe - sofort ohne Termin!
- Online-Chat 14-20 Uhr
- 700 Lerntexte & Videos
- Über 250.000 Übungsaufgaben
Einzelnachhilfe Online
Du benötigst Hilfe in Chemie? Dann vereinbare einen Termin bei einem Lehrer unserer Chemie-Nachhilfe Online. Lehrer zum Wunschtermin online fragen!
- Online-Nachhilfe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Nachhilfe in deiner Nähe
Du möchtest Hilfe von einem Lehrer der Chemie-Nachhilfe aus deiner Stadt erhalten? Dann vereinbare einen Termin in einer Nachhilfeschule in deiner Nähe.
- Nachhilfe in deiner Nähe
- Zum Wunschtermin
- Geprüfte Chemie-Nachhilfelehrer
Unsere Kunden über den Studienkreis
Weitere Erklärungen & Übungen zum Thema